Гонка и выживание. Когда все-таки ждать вакцин от коронавируса - «Общество»
Поскольку надежды ученых на быстрый коллективный иммунитет от COVID не оправдываются, главным способом борьбы с пандемией остаются несуществующие пока вакцины. Ситуация беспрецедентная: в мире никогда еще не разрабатывали вакцину быстрее, чем за пять лет. Руководитель научной экспертизы Inbio Ventures Илья Ясный сравнил вакцины, которые находятся на финишной прямой исследований: по оптимистичному сценарию, привиться можно будет к лету. Мировые производители, чтобы завоевать доверие людей, выбрали путь максимальной открытости, а российские, напротив, не спешат делиться закрытыми данными исследований.
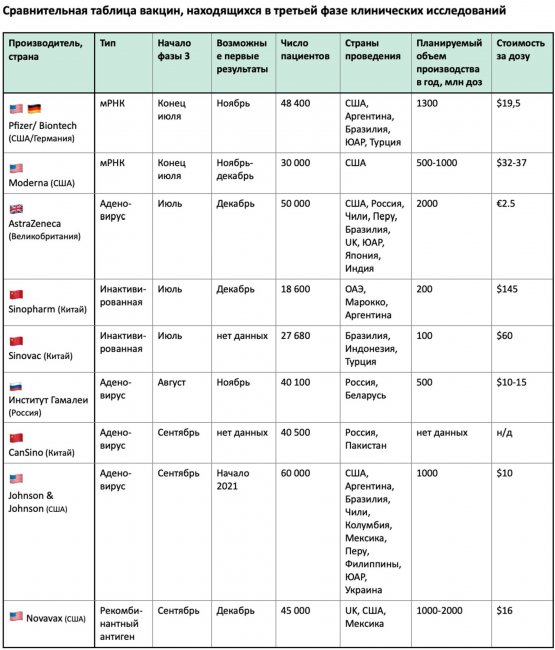
По всему миру на людях сейчас исследуют почти 50 вакцин от коронавируса, из них 10 находятся на третьей фазе испытаний, когда вакцинируют большие группы добровольцев. Среди лидеров выделяются четыре компании: Pfizer (в сотрудничестве с Biontech), Moderna (в сотрудничестве с Национальными институтами здоровья США), AstraZeneca (в сотрудничестве с Оксфордским университетом) и Johnson & Johnson. Все их вакцины основаны на технологиях, которые раньше для этих целей практически не использовались. Если с аденовирусными векторами (технологии AstraZeneca и J&J) какой-то опыт был, то Pfizer и Moderna используют совсем новые технологии на основе РНК.
Все четыре участника гонки начали исследования фазы 3 в конце лета – начале осени, и у всех есть шанс на публикацию результатов до конца года. Скорость публикации данных зависит от того, насколько эффективной окажется вакцина и от того, насколько активно протекает пандемия. Эффективность вакцины устанавливается в ходе двойных слепых рандомизированных плацебо-контролируемых исследований. Проще говоря, всех добровольцев разбивают на две группы, из которых одна получает вакцину, а другая – плацебо, причем ни добровольцы, ни врачи, вводящие вакцину, не знают, кто в какой группе.
Эффективность и безопасность
Во всех четырех исследованиях первичная конечная точка, по которой судят об успешности исследования, – меньшее количество инфицированных в группе вакцины по сравнению с плацебо-группой. Порог эффективности устанавливается заранее: американское управление по лекарствам FDA установило, что вакцина будет признана эффективной только если она снизит заражение на 50%. Европейское агентство по лекарствам ЕМА недавно заявило, что может одобрить и вакцину с эффективностью менее 50%, если она будет достаточно безопасной.
Вторичные конечные точки – это иммуногенность, то есть наличие антител и других параметров иммунного ответа. Важно заметить, что пока всё, что известно о вакцинах против коронавируса – что они приводят к выработке антител у большинства вакцинированных добровольцев. Пока неизвестно, будут ли эти антитела как-то защищать от инфекции. При вакцинации могут выработаться как защитные антитела, так и те, что не будут защищать или даже будут вредить (хотя вероятность последнего сценария специалисты считают небольшой). В истории разработки вакцин бывали случаи, когда антитела вырабатывались, но от вируса не защищали: так было с вакцинами от ВИЧ и герпеса.
О вакцинах против коронавируса известно лишь то, что они приводят к выработке антител. Пока неизвестно, будут ли эти антитела защищать от инфекции
Беспрецедентная спешка, с которой разрабатываются новые вакцины, и давление политиков на создателей вакцин вызывают в обществе закономерные опасения, что в широкое применение попадут недостаточно протестированные препараты. Поэтому в США девять крупнейших фармкомпаний (Pfizer, Moderna, AstraZeneca, BioNTech, GlaxoSmithKline, Johnson & Johnson, Merck, Novavax и Sanofi) обязались придерживаться самых высоких стандартов безопасности и строгих научных принципов при разработке и регистрации вакцин.
Регуляторы также установили критерии для минимальной оценки безопасности перед регистрацией: FDA требует, чтобы с момента набора половины пациентов в исследование прошло не менее двух месяцев, а у ЕМА требование с точки зрения количества пациентов: их должно быть не меньше нескольких сотен. В противном случае не удастся оценить редкие, но потенциально опасные нежелательные явления.
Оптимистичный сценарий: вакцины станут доступны к лету
Демонстрируя свою приверженность принципам открытости и, очевидно, для повышения доверия со стороны публики, все четыре компании-лидера опубликовали протоколы своих исследований: это беспрецедентный шаг, раньше такие документы оставались исключительно внутренним делом фармкомпаний и организаторов исследования. Из них мы, в частности, смогли узнать, какие критерии для признания вакцины эффективной установлены компаниями. Например, AstraZeneca проведет промежуточный анализ после 75 случаев заражения участников исследования, Moderna – после 53, а Pfizer – и вовсе после 32. Именно поэтому считается, что Pfizer может первым объявить о результатах исследования. Теоретически, при наилучшем раскладе это могло произойти и в октябре, однако на начало ноября такого объявления сделано не было, несмотря на давление со стороны Трампа. Тем временем 1 октября AstraZeneca подала документы на так называемый rolling review в Евросоюзе. Эта процедура позволяет ЕМА рассматривать документы по мере готовности и существенно ускоряет процесс регистрации. Вакцина Pfizer стала вторым кандидатом, чье досье рассматривается ЕМА в рамках rolling review c 6 октября.
Вероятно, четыре основных участника гонки вакцин, или хотя бы некоторые из них, объявят о положительных результатах в ноябре-декабре 2020 года. Исследования после этого будут продолжаться, но одновременно компания-счастливчик обратится в FDA за разрешением на экстренное использование (EUA) – специальный регуляторный статус для экстренных ситуаций, при котором дистрибуция и применение препарата контролируется государственными структурами — и в ЕМА на ускоренное одобрение. При таком оптимистичном сценарии вакцины станут широко доступны к маю – июлю 2021 года. Есть и пессимистический сценарий: вакцины не покажут нужной эффективности и придется ждать других кандидатов, которых, как мы уже упоминали, немало.
Поводы для пессимизма
У ряда компаний возникли препятствия в ходе фазы 3. AstraZeneca приостановила исследование 8 сентября в связи с тяжелым нежелательным явлением (по слухам, речь идет о воспалении оболочек спинного мозга, причем это уже второй случай в исследовании), однако уже 16 сентября исследование в Великобритании было продолжено. FDA потребовалось больше времени, чтобы убедиться в отсутствии связи между вакцинацией и нежелательным явлением, и в США исследование возобновилось только 23 октября. Компания J&J также приостанавливала свое исследование 12 октября, чтобы разобраться в причинах инсульта у одного пациента, и продолжила его с 23 октября.
Поскольку основные вакцины, на которые сегодня надеются, сделаны по новым технологиям, риск их неуспеха достаточно велик. Поэтому не исключено, что в гонке их обойдут вакцины, разработанные по более традиционным технологиям: их разрабатывают вакцинные гиганты Sanofi и GSK, китайская Sinopharm, американская Novavax и другие компании.
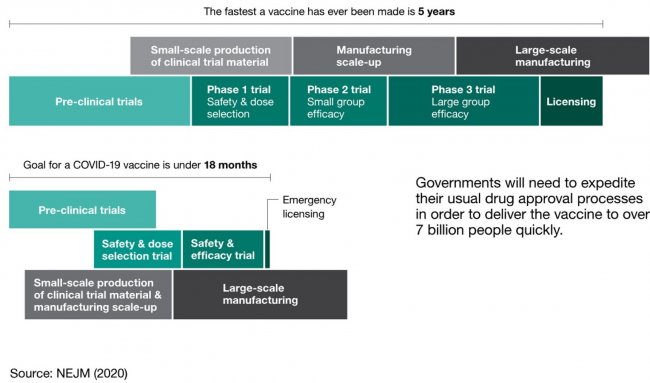
В нормальное время разработка вакцины занимает 10-12 лет (см. схему ниже), и по статистике только около 15-30% вакцин, входящих в клинические исследования, доходят до регистрации. Быстрее, чем за 5 лет, вакцину раньше вообще не разрабатывали. Кроме того, впервые до фазы 3 добрались разработки вакцин именно от коронавируса. Но даже если добиться полной защиты не получится, есть и компромиссные сценарии. Вакцина может, например, снижать тяжесть заболевания, долю госпитализированных пациентов или смертность. Такая вакцина не повлияет на ход пандемии, в отличие от вакцины, обеспечивающей защиту от заражения, но и она, безусловно, будет полезна.
Обычный процесс разработки вакцин (вверху, минимальный срок 5 лет) и во время пандемии коронавируса (внизу, срок 18 месяцев).
Источник
Спутник V: нет прозрачности — нет доверия
В России самым продвинутым кандидатом остается вакцина Cпутник V (на основе аденовирусов), разработанная НИЦЭМ им. Гамалеи. 29 сентября директор института Александр Гинцбург в интервью Reuters пообещал опубликовать промежуточные результаты фазы 3 в октябре-ноябре. Также он сказал, что, в отличие от FDA, рассчитывает на эффективность вакцины в 75%, а не 50%. Протокол исследования не публиковался, однако со слов тех, кто его видел, ожидаемая величина эффекта там составляет те же 50%, что и в руководстве FDA. При этом в российском протоколе отсутствует информация о промежуточном анализе по эффективности, в отличие от протоколов Moderna, AstraZeneca и других компаний, где четко описаны статистические критерии, по которым вакцина будет считаться эффективной во время промежуточного анализа. Это довольно тревожный знак для исследования Спутника V: отсутствие заданных заранее критериев промежуточной эффективности дает простор для придумывания таких критериев «на ходу», и вкупе с частичным разослеплением исследования (проще говоря, «подглядыванием» в результаты) снижает научную целостность исследования и доверие специалистов к результатам.
Уровень доверия к российской вакцине демонстрируют опросы, проведенные в августе и октябре «Левада-центром». О неготовности прививаться Спутником V в августе сообщили 53,8% респондентов, а в октябре – 59% (среди подписчиков The Insider «В контакте» таких и вовсе 75%). Одна из возможных причин – широко транслируемый государственными СМИ лозунг об эффективности и безопасности вакцины, которая была протестирована на 20 молодых и здоровых людях. Непрозрачность регистрации вакцины также не способствует повышению доверия к ней. Минздрав, как всегда, нарушая статью 37 закона 61-ФЗ, не разместил на своем сайте информацию о проведенной экспертизе вакцины, поэтому независимые эксперты не могут понять, на каком основании она зарегистрирована. Не вызывают доверия опечатки и ошибки в инструкции к вакцине: так, диарея отнесена там к заболеваниям нервной системы.
В инструкции к «Спутнику V» диарея отнесена к заболеваниям нервной системы
В репортаже ВВС приводятся тревожные сведения о том, что для участия в исследовании фазы 3 государственные организации отправляют сотрудников в обязательном порядке, что является грубым нарушением законов РФ и этических принципов проведения экспериментов над людьми, изложенных в Хельсинкской декларации.
Сообщения о том, что участники исследования заразились коронавирусом, пока нельзя ни подтвердить, ни опровергнуть. Во-первых, они действительно могли получить плацебо, как замечает Александр Гинцбург, а во-вторых, ни одна вакцина не обеспечивает стопроцентной защиты, и, как уже говорилось, она при этом все равно может быть ценной.
Возможность выбора
Между тем, в России ускоренную регистрацию по результатам фазы 1/2 получила еще одна вакцина – ЭпиВакКорона производства новосибирского центра «Вектор» на основе пептидных антигенов. В отличие от Спутника V, результаты исследований по ней пока не опубликованы. Исследования фазы 3 на 3000 человек должны начаться в ноябре, в гражданский оборот вакцина может поступить в январе 2021 года.
Немаловажный аспект при разработке вакцин – масштабирование их производства. Так, вакцины на основе аденовирусов и РНК (то есть самые продвинутые) никто никогда еще не производил в масштабах миллионов доз. Обычно переход от производства в 5-10-литровом масштабе к масштабам в тысячи литров занимает не менее года. При этом нужно как поставить и наладить оборудование для производства и очистки продукта, так и провести валидацию процесса производства: кропотливый процесс доказывания того, что продукт на выходе стабильно получается качественным. В случае Спутника V к закупкам оборудования приступили только осенью, поэтому к окончанию фазы 3 вряд ли получится производить вакцину миллионами доз в месяц. Важно, чтобы при этом производители в спешке не шли на компромиссы с точки зрения обеспечения и контроля качества.
Впрочем, в России проводятся исследования вакцин AstraZeneca и CanSino, так что в случае их успеха у россиян будет надежда на выбор.
И будьте в курсе первыми!