«Спутник» и ложь во спасение. Почему у работоспособной вакцины плохая репутация - «Мнения»

Илья Ясный
руководитель научной экспертизы Inbio Ventures
«Спутник V» — вакцина, которая спасла немало жизней, и повод для гордости: Россия одна из немногих стран, справившаяся с самостоятельной разработкой. С другой стороны, процесс разработки, производства и распространения вакцины сопровождается таким количеством нарушений, дезинформации и некомпетентности, что репутация у препарата неоднозначная. Фактически в нем, как в капле воды, отразились проблемы российской науки, фармацевтики и пиара. Руководитель научной экспертизы Inbio Ventures Илья Ясный анализирует факты и домыслы вокруг «Спутника» и разбирается, почему Европа и ВОЗ до сих пор не одобрили российскую вакцину.
Дисклеймер: автор и его семья привились «Спутником».
Прежде всего, необходимо различать три вещи:
- принцип устройства «Спутника», который вполне разумен и похож на вакцины Johnson & Johnson, CanSino и AstraZeneca;
- то, как проводились исследования вакцины;
- заявления сотрудников центра Гамалеи и РФПИ, сопровождающие разработку и последующие стадии распространения вакцины.
Предыстория: Эбола и уголовное дело
Публичная история Спутника V началась 20 апреля 2020 года, когда директор института Гамалеи Александр Гинцбург на совещании у Путина заявил, что клинические исследования вакцины могут начаться 1 июня, а регистрация возможна с 15 июня. Конечно, постановление правительства разрешает сокращенный порядок исследований лекарств в период пандемии, но две недели на клинические исследования — это, мягко говоря, оптимистичный прогноз.
Правда, Гинцбург и другие сотрудники постоянно ссылаются на то, что платформа, на которой сделан «Спутник», хорошо изучена, и это уже третья вакцина, полученная по данной технологии. Действительно, раньше в России была зарегистрирована вакцина от Эболы, однако сделано это было в нарушение всяких правил по результатам фазы ½, результаты фазы 3 так и не были нигде опубликованы, а разрешение на исследование вписано в реестр задним числом.
Есть еще одна пикантная подробность: на самом деле «Спутник» — не третья, а четвертая попытка института Гамалеи создать векторную вакцину: первой была АдеВак-Флю, о которой сейчас Гинцбург не упоминает. Возможно, потому что деньги на ее создание были разворованы, а в хищении 424 млн рублей у Роснано обвиняется бывший сотрудник центра Гамалеи Рустам Атауллаханов. Гинцбургу и его заместителю Денису Логунову посчастливилось быть на этом процессе свидетелями.
Поспешная регистрация
В мае 2020 года разразился скандал с исследованием вакцины на сотрудниках института Гамалеи еще до тестирования на животных. Директор Гинцбург заявил, что это не имеет никакого отношения к клиническим исследованиям. Правда, по всем международным правилам, незарегистрированные новые препараты должны вводиться людям только в рамках клинических исследований: они должны подписывать информированное согласие, оформлять страховку и тщательно наблюдаться, потому что их здоровье и жизнь подвергаются повышенной опасности.
Наконец, регистрация вакцины 11 августа без каких-либо опубликованных данных стала настоящей сенсацией не только у нас, но и за рубежом, и оказала неоднозначное влияние на имидж вакцины. Все, что было доступно в течение двух месяцев — скупые данные из плохо написанной инструкции, из которых, однако, было понятно, что обе дозы вакцины в жидком виде получили ровно двадцать человек. Это не тянет даже на исследование фазы 2, не то что на регистрационное. Для сравнения, на тот момент детали по первым двум фазам исследований западных вакцин: Pfizer/BioNTech, AstraZeneca, Moderna уже были опубликованы в рецензируемых научных журналах, причем там участвовало в десятки раз больше человек, но никто не торопился регистрировать вакцину по этим предварительным данным.
Кроме того, сопровождающие регистрацию заявления о том, что это первая в мире зарегистрированная вакцина от коронавируса, не соответствуют действительности: 25 июня китайская вакцина CanSino была зарегистрирована для применения у военных. Также нелепо заявление разработчика Логунова о том, что временная регистрация необходима для вакцинации групп риска. Оно противоречит и мировой практике, и российскому руководству по клиническим исследованиям.
Публикации и испытания
В сентябре 2020 года в журнале Lancet вышла публикация результатов исследований фазы 1/2, которая подверглась резкой критике со стороны итальянского борца с лженаукой Энрико Буччи и других ученых с обвинениями в фальсификации данных. Группа Логунова ответила на критику, однако первичные данные, по которым можно было с уверенностью судить об отсутствии фальсификации, так и не были предоставлены. Но и помимо этой критики в статье много недостатков. Некоторое беспокойство с этической точки зрения вызвало то, что в исследовании принимали участия военные — это зависимая группа, и необходима особая внимательность, чтобы обеспечить добровольность и информированность участников.
В сентябре же началось исследование фазы 3. В отличие от всех ведущих производителей вакцин, протокол «Спутника» опубликован не был. Между тем протокол — это ключевой документ клинического исследования, в нем описывается схема эксперимента, заранее указывается, какой результат и по какому критерию исследователи считают успешным, сколько для этой цели нужно добровольцев и прочие подробности. Мне удалось ознакомиться с августовским черновиком протокола. На первый взгляд он неплохо написан и похож на протоколы западных компаний, однако есть некоторые важные нюансы: описание того, заболел человек ковидом или нет, недостаточно детально и довольно субъективно, что во многом оставляет решение за врачом. Это позволяет манипулировать данными, если знать, кто в группе плацебо, а кто — вакцины. При том, что вакцина чаще вызывает побочные реакции, такой подход может привести к завышению ее эффективности.
Решение, заболел участник исследования ковидом или нет, во многом остается за врачом
В протоколе «Спутника», в отличие от протоколов других компаний, отсутствовали промежуточные точки анализа. Между тем ждать 180 дней после включения в исследования последнего пациента — это и впрямь слишком долго, поэтому из публикации о фазе 3 мы узнаём, что промежуточные анализы были внесены туда в ноябре. Изменение протокола третьей фазы, когда исследование уже идет, может привести к получению невалидных результатов, и требуется большая осторожность и хорошие обоснования, что всё сделано правильно. Как нетрудно догадаться, в статье это никак не комментируется.
Неясна ситуация и с эффективностью «Спутника» против новых штаммов. В центре Гамалеи, конечно, утверждают, что он эффективен против них, не приводя никаких доказательств (ждите, мол, публикацию в мае). Независимые ученые проанализировали сыворотку привитых аргентинцев и установили, что она хуже нейтрализует южноафриканский вариант вируса.
Производство
Одновременно c фазой 3 начинается масштабирование производства вакцины и к процессу подключаются Генериум, Биокад, Р-Фарм и другие компании. Институт Гамалеи получил 1,5 млрд рублей, чтобы выйти на объемы производства 4–5 млн доз в месяц, но так до сих пор на эти объемы и не вышел. Передача производства в коммерческие компании повысила надежду, что вакцина будет качественной, но одновременно поставила вопрос о сопоставимости продуктов, произведенных на разных площадках. Скажем, продукт, произведенный в институте Гамалеи в реакторах объемом 5 л для целей клинического исследования совсем не обязан быть таким же, как произведенный в Генериуме в реакторе 1000 л для массового применения. Их сопоставимость требует отдельных исследований. О неполной сопоставимости косвенно свидетельствуют разные указания о хранении и применении для продукта разных производителей в инструкции на препарат.
Дальше обещания по количеству доз постоянно обгоняли реальные темпы производства. Впрочем, в том, что производство не удалось сразу масштабировать, нет ничего удивительного — в России не было опыта самостоятельного производства и масштабирования качественных инновационных препаратов, а к закупке оборудования для масштабирования приступили только в конце сентября. Итого на 12 мая в России произведено 33 млн доз, из которых экспортировано 15 млн. Так, Мексика получила 1,9 млн доз из положенных по контракту 24 млн. Минздрав Мексики заявил, что это из-за проблем с производством второй дозы, но РФПИ утверждает, что это неверная информация.
Наконец, в конце ноября были объявлены предварительные результаты третьей фазы для всех ведущих вакцин, в том числе для «Спутника». Как и у Pfizer и Moderna, эффективность «Спутника» оказалась на уровне 95%. Данные были опубликованы в виде пресс-релизов, но для западных вакцин более подробная информация стала довольно быстро доступной после одобрения вакцин в США и ЕС — агентства на этих территориях, в отличие от Минздрава РФ, публикуют подробную информацию и от производителя, и от регулятора, а в США доступно еще и видео заседания научного комитета. Подробностей о «Спутнике» пришлось подождать до февраля 2021 года, когда вышла статья в журнале Lanсet о результатах фазы 3. Впервые результаты исследования третьей фазы российского препарата были опубликованы в таком престижном международном журнале. Правда, и к этой публикации у исследователей возникли вопросы, которые во многом могли бы быть сняты предоставлением протокола исследования и первичных данных. В частности, выяснилось, что реактогенность вакцины вовсе не изучали. По руководству после прививки нужно собирать информацию о реакции на вакцину в течение нескольких суток, опрашивая пациентов. В протоколе это не было предусмотрено.
Сопоставимость вакцин, произведенных на разных площадках, нужно отдельно исследовать
Тем не менее в ноябре-декабре 2020 года начали накапливаться сведения из Telegram-каналов о привитых «Спутником». И у пожилых, и у людей с сопутствующими заболеваниями не наблюдалось серьезных побочных эффектов, вырабатывались антитела. Это в итоге и убедило меня посоветовать родителям привиться. Конечно, такая ситуация ненормальна, источником достоверной информации о лекарствах должны быть не соцсети, а официальные данные.
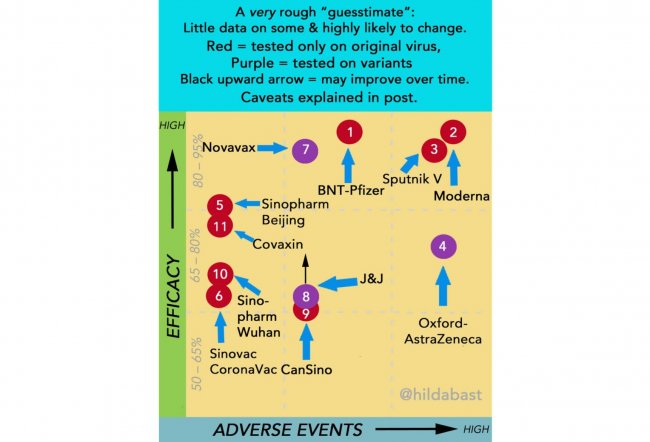
Правда, теперь у нас есть данные реального применения из Аргентины и Сан-Марино (но не из России). Надежно можно оценить разве что безопасность вакцины — количество побочных эффектов в сан-маринском исследовании находится на верхней границе других вакцин. Исследовательница Хильда Бастиан, одна из основателей Кокрейновского общества и эксперт по доказательной медицине, проводит сравнение вакцин по эффективности и безопасности, оговариваясь, что это ориентировочный график, потому что сравнивать данные из разных исследований напрямую не вполне корректно. На рисунке приведены данные на середину мая.
Как мы видим, у «Спутника» высокая заявленная эффективность, но и высокий уровень побочных эффектов. Число новых случаев ковида в Сан-Марино снизилось до нуля, при том, что «Спутником» там прививалось 80% населения.
Экспорт за рубеж
К «Спутнику» стали проявлять интерес в других странах — к ноябрю 2020 года заявки поступили из 50 стран на общий объем 1,2 млрд доз. Однако уже в декабре начались первые трения — Турция отказалась покупать «Спутник V» по причине несоответствия доклинических исследований надлежащей лабораторной практике (GLP, Good Laboratory Practice). Эти стандарты обеспечивают качественное выполнение исследований на животных, в первую очередь на токсичность. Если они не выполняются, нельзя быть уверенным, что препарат хорошо проверили на безопасность.
В ответ Гинцбург заявил, что «лабораторное производство сертифицировано по стандартам Минпромторга, но не по европейским сертификационным органам. У нас нет европейского сертификата, а имеем российский, как и вся наша промышленность». Это очень странный ответ — в претензии Турции речь шла вовсе не о производстве, а о доклинических исследованиях. Лабораторное производство не сертифицируется, лицензируется только промышленное производство. Стандарты лицензирования Минпромторга — это почти копия европейских стандартов.
Турция заявила, что проведет собственные исследования вакцины. Проделав это, турки одобрили вакцину 30 апреля и закупили 50 млн доз. Также они организуют собственное производство.
Вообще, для контекста важно понимать, что весь мир делится на две большие зоны — страны, где приняты самые современные нормы в отношении лекарств, разрабатываемые ICH (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к лекарствам для медицинского применения), и остальные страны. Наиболее сильное и современное регулирование в США, ЕС, Японии, Швейцарии, Канаде. Важно подчеркнуть, что эти руководства — не бюрократические преграды на пути производителей, выстроенные злой «бигфармой», а стройная, научно обоснованная, выстраданная после многих инцидентов система, обеспечивающая население этих стран безопасными, эффективными и качественными лекарствами.
Две страны Евросоюза вступили в переговоры с РФПИ о поставках «Спутника», несмотря на отсутствие одобрения со стороны ЕМА и ВОЗ: Венгрия и Словакия. Венгрия одобрила вакцину еще в январе 2021-го, но продолжала свои внутренние проверки. В феврале началась массовая вакцинация населения. Со Словакией получилось сложнее: одобрение вакцины и решение о закупке «Спутника» привело к политическому скандалу внутри страны. Затем, получив первые образцы вакцины, словаки заявили, что они не соответствуют тому, что было опубликовано в The Lancet, а данных из досье недостаточно, чтобы судить о безопасности и эффективности вакцины.
В ответ РФПИ потребовал вернуть поставленные 200 000 доз, ссылаясь на нарушение словаками контракта, в соответствии с которым вакцину могли тестировать только в сертифицированных ЕС лабораториях. Тогда Словакия опубликовала контракт, из которого видно, что там нет таких указаний. Однако 9 мая Словакия сообщила, что дозы, отправленные на тестирование в Венгрию, оказались удовлетворительного качества, и 26 мая одобрила вакцину для применения в стране. А чешский регулятор ранее заявлял, что данных в досье недостаточно, и они прекращают рассмотрение документов.
Наверное, самый громкий скандал разразился в Бразилии. Тамошнее регуляторное агентство ANVISA заявило, что пока не разрешит регистрацию «Спутника V» по причине неполноты данных и сразу нескольких моментов, которые беспокоят агентство:
- в документации на продукт установлена довольно высокая планка обнаружения реплицирующегося аденовируса. Если такой аденовирус действительно обнаруживается, это не соответствует заявлениям российской стороны о его отсутствии, и в таком случае к нему предъявляются более высокие требования по изучению безопасности. В частности, такой аденовирус может накапливаться в тканях. Этот пункт привлек больше всего общественного внимания и на него был дан ответ со стороны Гамалеи, что они просто очень торопились и не успели валидировать более строгие тесты. На самом деле уровень реплицирующегося аденовируса не выше допустимого;
- отсутствует информация о контроле наличия других вирусов в продукте, информация о контроле процесса производства на наличие примесей представлена не полностью;
- протокол клинического исследования фазы 3 нечетко описывает критерии болезни, алгоритм сбора данных о нежелательных явлениях и другие аспекты исследования, из-за чего повышается возможность манипулирования данными;
- данные о реактогенности не собирались совсем;
- нет данных о сравнимости между сериями, произведенными для клинических исследований в институте Гамалеи в объеме 5 л и между коммерческими сериями, произведенными в объеме сотен литров;
- аудит бразильцев на площадках «Генериум» и «УфаВита» выявил недостатки производственных процессов, в частности, риск нарушения стерильности;
- на площадку Гамалеи бразильцев вообще не пустили.
РФПИ пообещал подать на ANVISA в суд за клевету. Но часть этих замечаний была понятна и до ANVISA, и их в любом случае придется устранить до того, как ЕМА или ВОЗ одобрят вакцину. Если РФПИ и Гамалея хотят зарегистрировать вакцину в Евросоюзе (а им было выдано такое распоряжение, как говорится, «на самом верху»), им придется пустить аудиторов ЕМА даже на такой сверхсекретный объект, как центр Гамалеи.
Между тем в Бразилии местная компания União Química наладила собственное производство «Спутника» по лицензии и подала на регистрацию. Так же поступила и индийская Dr. Reddy’s, причем индусы еще и провели собственное клиническое исследование, а также налаживают самое масштабное производство «Спутника» в мире.
Пиар черный и белый
Тут самое время упомянуть о позиции, которую занимают пиарщики РФПИ при любой попытке критиковать вакцину и даже просто сравнить ее с другими аналогами. С самого начала фонд сделал ставку не на открытость и готовность к диалогу, а на защитно-агрессивную позицию, причем с акцентом на принижение достоинств других вакцин и безапелляционные заявления о 97-процентной эффективности «Спутника». Так, в пресс-релизе написано, что заболеваемость среди 3,8 миллионов привитых россиян в январе-марте 2021 года составила 0,027%. Это означает, что среди дважды привитых «Спутником V» заболело 1026 человек. При этом, согласно информации Мосгорздрава, около 1000 человек к 31 марта заболело только среди миллиона привитых москвичей. Противоречие в цифрах очевидно.
На все упомянутые выше сигналы из разных стран представители РФПИ отвечали, что это «фейк-ньюс», была подключена и риторика «информационной атаки» на «Спутник» со стороны Госдепа США и подконтрольных ему организаций. Правда, государственная пропаганда США дала повод: согласно отчету Департамента здравоохранения США за 2020 год, они «убеждали Бразилию отказаться от российской вакцины». Отчет стыдливо удален с сайта Департамента, но кэш всё помнит.
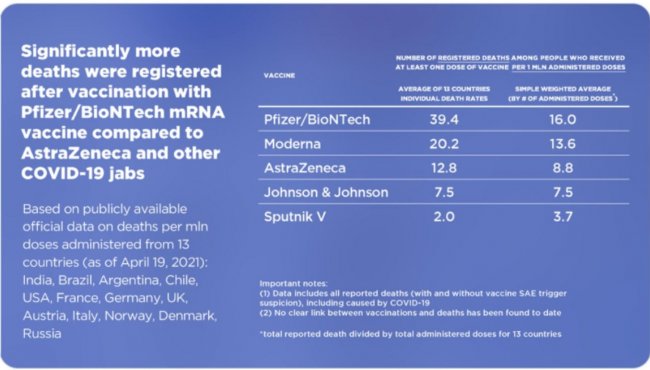
Что касается очернения конкурентов, самая вопиющая история — с табличкой из Венгрии. В Twitter РФПИ была опубликована таблица с заражениями и смертями после вакцинации различными препаратами, из которой можно сделать вывод, что после вакцинации Pfizer/BioNTech смертность в почти в 20 раз, чем после «Спутника».
Сравнительная таблица из Twitter Sputnik V.
Проблем с этой таблицей несколько:
- в первой колонке приведены цифры, не нормированные на число вакцинированных;
- приведены смерти от всех причин, а не только от вакцинации (да-да, ДТП и выпадения из окна тоже);
- возраст, заболеваемость ковидом (и другими болезнями), качество сбора данных — все это ключевым образом влияет на данные о смертности. Никакой поправки на всё это не вводилось.
- не учитывается, что вакцины используются в течение разного промежутка времени. Так, в США смертность от Pfizer — 10,4 на млн, а от J&J — 7,5 на млн. Но Pfizer используется с декабря, а J&J — c февраля. Конечно, у тех, кто получил Pfizer, было просто больше времени умереть!
- также надо учитывать, что Pfizer начали давать в первую очередь наиболее пожилым и уязвимым: понятно (всем, кроме жертв пропаганды РФПИ), что среди них смертность намного выше. Наоборот, «Спутник» в Венгрии не кололи хронически больным пациентам.
Такой черный пиар, как мы уже говорили, идет не на пользу всем вакцинам, включая «Спутник».
Регистрация в Евросоюзе: что мешает?
Если у РФПИ стоит цель зарегистрировать «Спутник» в ЕС, а в Евросоюзе все еще наблюдается дефицит вакцин, что же мешает зарегистрировать российский препарат прямо сейчас? Многие считают, что ЕМА специально затягивает процесс одобрения по политическим причинам, чтобы насолить России. Я не сторонник такой точки зрения. Проблемы, озвученные бразильским агентством ANVISA, действительно существуют, и их действительно достаточно, чтобы не дать регистрацию ЕМА. Агентство должно быть уверено, что проведенные исследования и производимые дозы действительно обеспечивают такой эффективный и безопасный продукт с надлежащим качеством, как это декларируется производителем.
К сожалению, и с ЕМА не обошлось без скандальной истории — начиная с января РФПИ принялся заявлять, что они уже подали заявку на регистрацию вакцины в ЕС. При этом на сайте ЕМА никаких сообщений об этом не было, в отличие от заявок других производителей. Но РФПИ упорно продолжал сообщать, что заявка на рассмотрении и вакцина может быть одобрена в начале марта. ЕМА пришлось даже выпустить специальный пресс-релиз о том, что это неправда. В ответ РФПИ, конечно, обвинил ЕМА в распространении «фейк-ньюс» (не самый лучший способ выстроить диалог с наиболее профессиональным агентством на планете), правда, потом выяснилось, что они загрузили документы не на тот сайт.
Впрочем, в ЕМА не обиделись и таки приняли заявку 4 марта. Правда, это заявка не на само одобрение, а на так называемый rolling review, то есть постепенное рассмотрение по мере того, как будут подаваться документы. Когда агентство придет к выводу, что документов достаточно для подачи заявки на регистрацию и польза перевешивает риск, будет приниматься решение о регистрации.
ЕМА и ВОЗ объединили усилия по рассмотрению заявки на «Спутник» и уже провели аудиты, о результатах которых ничего пока не известно. Документ ВОЗ от 18 мая сообщает, что еще не все данные от Гамалеи получены, и аудиты продолжатся до июня. Значит, вряд ли регистрация «Спутника» произойдет раньше июля. Нужен ли он к тому моменту будет в ЕС в тех количествах, в которых его сейчас удается произвести — это вопрос. Однако если препарат получит преквалификацию ВОЗ, это откроет ему дорогу во множество развивающихся стран по программе COVAX.
Заключение
Ситуация со «Спутником» непростая и, с одной стороны, уникальна, с другой — вполне ожидаема. Впервые лекарство из России оказалось под пристальным вниманием высочайших профессионалов всего мира. И, наверное, заслуженно: вакцина действительно спасает жизни и вроде бы не обладает серьезными побочными эффектами. «Спутник» уже одобрен более чем в 60 странах.
Однако ее родовые пятна — непрозрачность разработки, закрытость информации, проблемы с пиаром, а то и откровенная ложь — очень мешают продвижению «Спутника» в мире. Очень надеемся, что эти ошибки будут учитываться и исправляться со временем, ведь путь к их исправлению начинается с признания.
И будьте в курсе первыми!